Ртути и меди - два элемента, которые встречаются в нашей повседневной жизни. Они оба являются металлами и имеют широкий спектр применений в различных областях, начиная от электроники и медицины, и заканчивая химической промышленностью и строительством. Однако различия в строении и свойствах атомов ртути и меди демонстрируют, насколько разные они по своей природе.
Атом ртути имеет атомный номер 80 и химический символ Hg (от латинского названия "hydrargyrum"). Этот элемент относится к группе переходных металлов и находится в периодической таблице между золотом и таллием. Атомный радиус ртути составляет около 150 пикометров.
С другой стороны, медь имеет атомный номер 29 и химический символ Cu (от латинского названия "cuprum"). Элемент находится в периодической таблице между никелем и цинком. Атомный радиус меди составляет около 135 пикометров.
Одним из основных различий между атомами ртути и меди является их электронная конфигурация. Ртуть имеет полный s-подуровень в своей внешней оболочке. Это делает ртуть стабильным элементом и неметаллическими свойствами. С другой стороны, медь имеет неполностью заполненный d-подуровень и может образовывать соединения с другими элементами.
Структура атомов ртути и меди

Атомы ртути и меди имеют схожую структуру, состоящую из ядра и облака электронов.
Ядро атома ртути состоит из 80 протонов и обычно имеет 120-180 нейтронов, что делает его одним из самых тяжелых ядер. Это объясняет высокую плотность и массу ртути. У атома ртути также есть 80 электронов, которые образуют облако электронов вокруг ядра.
Атом меди содержит 29 протонов в ядре и обычно 34 нейтрона. Это объясняет относительно более низкую плотность и массу меди по сравнению с ртутью. У атома меди также есть 29 электронов, образующих облако электронов вокруг ядра.
Важно отметить, что структура электронных облаков ртути и меди имеет различия в расположении электронных орбиталей и заполнении электронных подуровней. Это влияет на химические свойства и возможности образования различных соединений данных элементов.
- Атомы ртути и меди имеют схожую структуру ядра и облака электронов.
- Ртуть имеет большую плотность и массу из-за большего числа протонов и нейтронов в ядре.
- У меди относительно более низкая плотность и масса, чем у ртути.
- Физические и химические свойства данных элементов различны из-за различий в структуре и расположении электронных орбиталей.
Внешняя оболочка и количество электронов
Атомы ртути и меди имеют разные внешние оболочки и количество электронов. Ртуть находится в 12-й группе периодической системы и имеет обычно 6 электронов в своей внешней оболочке. Это делает ртуть химически активной и способной к образованию различных соединений.
Медь находится в 11-й группе и имеет 1 электрон в своей внешней оболочке. Это делает медь относительно устойчивой и менее активной химической элементом, чем ртуть.
Различия во внешней оболочке и количестве электронов в атомах ртути и меди влияют на их реакционную способность и химические свойства. Количество электронов во внешней оболочке определяет возможность образования связей с другими атомами и образование соединений.
Ядро атома и количество протонов и нейтронов
Количество протонов в ядре атома определяет его атомный номер и химические свойства. Протоны также определяют заряд атома. Например, у атомов ртути и меди атомные номера равны 80 и 29 соответственно. Это означает, что у ртути в ядре находится 80 протонов, а у меди – 29 протонов.
Нейтроны в ядре атома также влияют на его свойства. Они не имеют заряда, поэтому не влияют на химические реакции и связи атома. Однако количество нейтронов может варьироваться для атомов одного и того же элемента. У ртути количество нейтронов составляет около 121, а у меди – около 35.
Знание количества протонов и нейтронов в ядре атома помогает понять его химические и физические свойства, а также его положение в таблице химических элементов.
Физические свойства ртути и меди

| Свойство | Ртуть | Медь |
|---|---|---|
| Плотность (г/см³) | 13,55 | 8,96 |
| Температура плавления (°C) | -38,83 | 1083 |
| Температура кипения (°C) | 356,74 | 2567 |
| Электропроводность (S/m) | 1,06 x 10^6 | 5,96 x 10^7 |
| Магнитная восприимчивость (пог. ед.) | -1,84 x 10^-5 | 1,79 x 10^-5 |
Как видно из таблицы, ртуть имеет большую плотность и нижнюю температуру плавления по сравнению с медью. Однако, у меди выше температура кипения. Важно отметить, что медь обладает более высокой электропроводностью и магнитной восприимчивостью по сравнению с ртутью.
Эти различия в физических свойствах делают ртуть и медь полезными в различных применениях. Например, ртуть используется в термометрах на основе расширения жидкости, а медь широко применяется в электротехнике и производстве проводов.
Температура плавления и кипения
Атомы ртути и меди имеют различные температуры плавления и кипения.
Температура плавления ртути составляет -38,87 °C, что делает ее одним из немногих металлов, которые находятся в жидкой форме при комнатной температуре. Благодаря этому свойству, ртуть широко используется в различных технических и научных областях.
Медь, с другой стороны, имеет гораздо более высокую температуру плавления, которая составляет около 1084 °C. Благодаря этому свойству, медь является основным материалом для изготовления проводников электропитания и теплопроводных устройств, таких как радиаторы и термосифоны.
Когда речь идет о температуре кипения, ртуть имеет одну из самых низких температур среди металлов. Ее температура кипения составляет около 357 °C. Медь, с другой стороны, не кипит при обычных условиях, а переходит непосредственно из твердого состояния в газообразное при очень высоких температурах.
Различия в температуре плавления и кипения ртути и меди определяют их специфические свойства и применение в различных отраслях промышленности и науки.
Плотность и твердость
Плотность - это масса вещества, содержащегося в единице объема. Атомы ртути имеют более высокую плотность по сравнению с атомами меди. Это объясняется тем, что атомы ртути взаимодействуют между собой сильнее, образуя более плотную структуру.
Твердость - это сопротивление вещества деформации или разрушению под воздействием внешних сил. Атомы меди обладают более высокой твердостью по сравнению с атомами ртути. Это связано с тем, что медь является металлом, который образует кристаллическую решетку сильных химических связей. Атомы ртути, в свою очередь, образуют слабые связи, что делает их более мягкими и менее устойчивыми к давлению и деформации.
Итак, плотность и твердость являются важными различиями между атомами ртути и меди. Атомы ртути имеют более высокую плотность, благодаря более плотной структуре, в то время как атомы меди обладают более высокой твердостью, благодаря кристаллической решетке и сильным химическим связям.
Химические свойства ртути и меди

Одно из основных свойств ртути - ее низкая температура кипения (356,7 °C) и плавления (-38,83 °C), благодаря чему она находится в жидком состоянии при комнатной температуре. Также ртуть обладает отличной электропроводностью и способностью к жидкому агрегатному состоянию.
Медь, с другой стороны, является химическим элементом с атомным номером 29 и обозначением Cu. Она является одним из самых распространенных металлов в мире и имеет множество полезных свойств.
Одно из основных свойств меди - ее высокая электропроводность. Медь также обладает прекрасной теплопроводностью и хорошими антикоррозионными свойствами. Она может быть легко обработана и применяется во многих отраслях, включая электронику, строительство и производство.
Хотя ртуть и медь имеют различные химические свойства, они имеют некоторые схожие характеристики. Оба элемента обладают высокой плотностью и являются металлами. Они также используются в различных отраслях промышленности и имеют важное значение для различных технологических процессов.
Реакции с кислородом
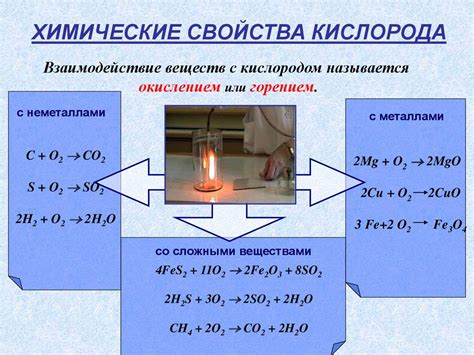
Атомы ртути и меди обладают разной реакционной способностью при контакте с кислородом.
Взаимодействие атомов ртути с кислородом может привести к образованию оксидов ртути, например, ртутного(II) оксида (HgO) или ртутного(I) оксида (Hg2O). Эти оксиды обладают различными свойствами и могут использоваться в разных отраслях науки и промышленности.
С другой стороны, медь реагирует с кислородом, образуя оксид меди (CuO), который обладает характерным черным цветом. Оксид меди имеет широкое применение, включая использование в качестве катализатора в различных химических реакциях.
Таким образом, атомы ртути и меди имеют различную реакционную способность с кислородом и могут образовывать разные оксиды при взаимодействии с ним.
Реакции с кислотами
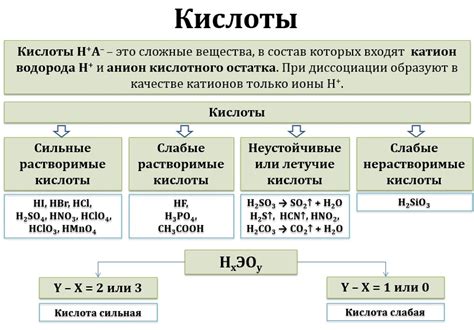
Когда атомы ртути и меди встречаются с кислотами, происходят различные реакции.
Ртуть обладает свойством реагировать с различными кислотами, образуя соответствующие соли. Так, при контакте с соляной кислотой (HCl), атомы ртути образуют хлорид ртути (HgCl2), который является белым кристаллическим соединением. Соляная кислота может также вызывать реакцию с ртути и образование других хлоридов ртути, в зависимости от условий и концентрации.
Серная кислота (H2SO4) также вызывает реакцию с ртутью. При этом образуются сульфаты ртути (HgSO4), которые являются твердыми солями. Реакция происходит с выделением сероводорода (H2S).
Медь, в отличие от ртути, не реагирует с обычными кислотами, такими как соляная и серная кислоты. Однако, медь может реагировать с некоторыми специальными кислотами, такими как концентрированный азотная (HNO3) или серную кислоту в присутствии нитрита (HNO2), образуя соответствующие соли меди, такие как азотнокислая медь (Cu(NO3)2) или нитрит меди (Cu(NO2)2).
Таким образом, хотя атомы ртути и меди обладают некоторыми сходствами в их реакциях с кислотами, они также имеют и явные различия в своем поведении в присутствии различных кислотных соединений.
Применение ртути и меди

Кроме термометров, ртуть также используется в барометрах для измерения атмосферного давления и в специальных аналоговых коммутаторах. Ртуть также находит свое применение в электронных устройствах и приборах, таких как ртутные выпрямители, галогеновые лампы и ртутные диоды. Это обусловлено высокой кондуктивностью ртути и ее способностью передавать ток, а также ее уникальными электрохимическими характеристиками.
Медь, в свою очередь, также имеет широкий спектр применений. Медные изделия широко используются в строительстве и электротехнике из-за их высокой электропроводности. Медные провода и кабели являются основными компонентами электрических систем.
Медь также используется в производстве монет, а также для создания украшений и ювелирных изделий. Благодаря своей прочности и привлекательному внешнему виду, медь является популярным материалом среди дизайнеров и художников. Кроме того, медь используется в медицине, как антимикробное средство и при изготовлении медицинских приборов.
Таким образом, ртуть и медь находят свое применение в различных отраслях благодаря своим уникальным свойствам. Их использование позволяет создавать надежные, эффективные и устойчивые к воздействию внешних факторов изделия и приборы.
Использование в электротехнике

Атомы ртути и меди широко применяются в электротехнике благодаря своим уникальным свойствам и химическим составам. Оба элемента используются для создания различных электрических устройств и проводников, где они выполняют разные функции.
Атомы ртути используются в ртутных выпрямителях, где они помогают преобразовывать переменный ток в постоянный и выполнять другие функции стабилизации напряжения. Ртутные выпрямители обычно применяются в промышленных и высококачественных электротехнических устройствах.
Атомы меди, с другой стороны, широко используются для создания проводников и электрических контактов. Медь является одним из лучших проводников электричества, благодаря своей высокой электропроводности и низкому сопротивлению. Она используется в электропроводках, электрических кабелях, контактах разъемов и других электрических компонентах.
Вместе с тем, ртуть и медь могут использоваться совместно в некоторых электротехнических устройствах. Например, ртутные выпрямители могут содержать медные контакты для обеспечения электрической связи с другими компонентами.
| Свойства | Ртуть | Медь |
|---|---|---|
| Электропроводность | Низкая | Высокая |
| Сопротивление | Высокое | Низкое |
| Температурный коэффициент сопротивления | Высокий | Низкий |
В целом, использование атомов ртути и меди в электротехнике обеспечивает разнообразные возможности для создания электрических устройств и оборудования. Сочетание их свойств и химических составов позволяет получать желаемые электрические характеристики и обеспечивать надежность и эффективность работы электротехнических систем.
Применение в медицине
Атомы ртути и меди имеют широкий спектр применения в медицине.
Атомы ртути используются в стоматологии для создания амальгамных пломб, которые используются для восстановления зубов и заполнения полостей после удаления кариозной ткани. Ртуть также используется в некоторых медицинских приборах, таких как термометры и барометры.
Атомы меди используются в качестве микроэлементов в некоторых препаратах и пищевых добавках, таких как медицинские препараты для лечения анемии, антиоксиданты и препараты для снижения уровня холестерина. Кроме того, медная паста широко используется в косметике для лечения определенных видов кожных заболеваний, таких как акне и экзема.
Оба этих металла также используются в диагностике и лечении рака. Ртути применяют в качестве контрастных агентов для улучшения качества изображений при проведении рентгенологических исследований. Медь, в свою очередь, активно используется в радиотерапии для лечения опухолей благодаря своим противоопухолевым свойствам.
В целом, атомы ртути и меди играют значительную роль в современной медицине и используются в различных областях, от стоматологии и косметологии до диагностики и лечения рака.



